1. 市販直後調査の概要
市販直後調査期間:2013年9月18日~2014年3月17日(販売後6ヵ月間)
推定投与症例数:360例
2. 副作用報告の概要
2013年9月18日から2014年3月17日までの期間(販売後6ヵ月)における、本剤との因果関係が否定できないとされた副作用報告は以下の通りです。
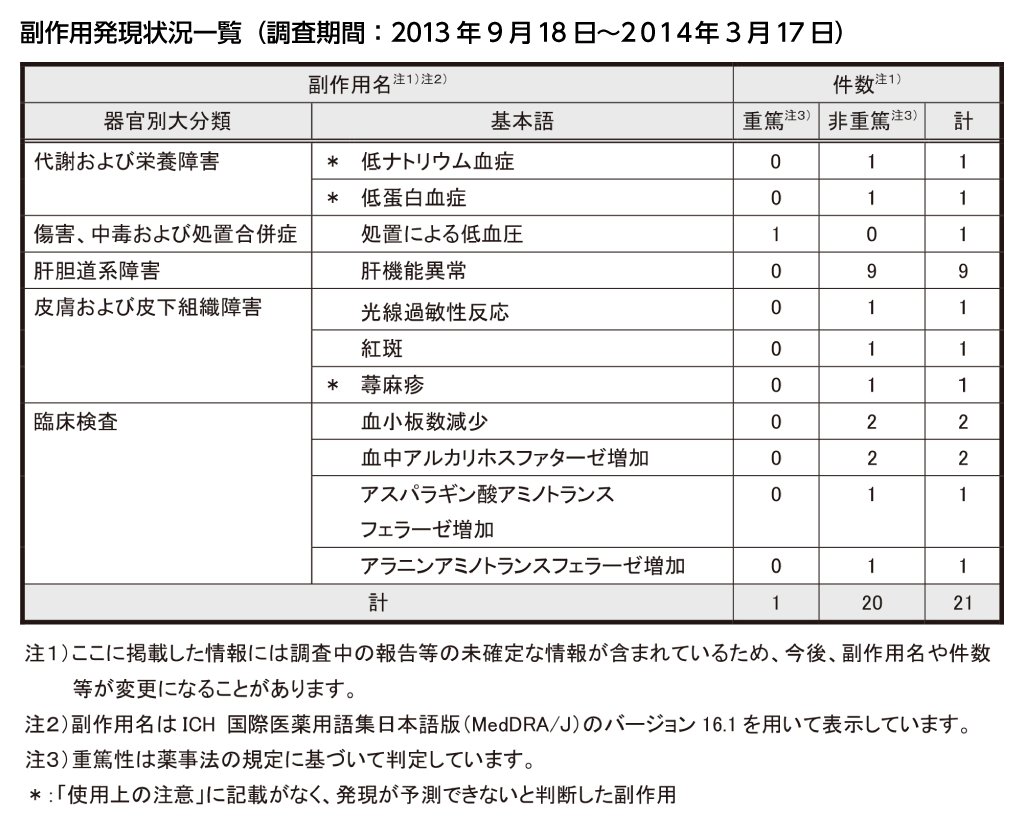
| 全ての副作用: | 16例 | 21件 |
| 重篤な副作用: | 1例 | 1件 |
-
「使用上の注意」から発現が予測できない副作用
本剤との因果関係が否定できないとされた副作用のうち、「使用上の注意」の記載等から発現が予測できないと判断した副作用は、低ナトリウム血症(回復)、低蛋白血症(未回復)及び蕁麻疹(未回復)の3件でした。いずれも非重篤の副作用でした。
-
重篤な副作用
本剤との因果関係が否定できないとされた重篤な副作用は、「処置による低血圧」の1件のみで、転帰は回復でした。
-
転帰が死亡とされた副作用
本剤との因果関係が否定できないとされた副作用のうち、転帰が死亡とされた副作用は、ありませんでした。
3. まとめ
2013年9月18日から2014年3月17日までの期間に報告された副作用を評価した結果、現時点においては「使用上の注意」の改訂等の安全確保措置の実施は不要と判断しました。
発現した全副作用は16例、21件で、「使用上の注意」から発現が予測できる既知の副作用がほとんどでした。重篤な副作用は、「処置による低血圧」の1件でした。非重篤な副作用20件のうち、未知の副作用が3件、既知の副作用が17件でした。なお、当該期間中に報告された副作用で最も多かった副作用は、肝機能異常でした。いずれも非重篤な症例でしたが、本剤の添付文書の「重大な副作用」に「肝機能障害」を記載し注意喚起を行っておりますので、観察を十分に行い、異常が認められた場合には、適切な処置をお願い致します。
今後とも副作用の発現状況等の安全管理情報の収集に努め、必要に応じて適正使用情報の提供等の安全確保措置を実施して参ります。


